Neurona
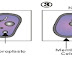
Una neurona es una célula nerviosa, elemento fundamental de la arquitectura nerviosa. Es la unidad funcional que transporta el flujo nervioso. Un cerebro humano contiene unos 100.000 millones de neuronas (1011).
Está formada por el cuerpo celular y diferentes prolongaciones:
Está formada por el cuerpo celular y diferentes prolongaciones:
El axón
aquí transitan los impulsos nerviosos o potenciales de acción desde el cuerpo celular hacia la siguiente célula. Los axones pueden agruparse y formar lo que comúnmente llamamos fibra nerviosa. La terminación axonal tiene forma abultada y se llama botón presináptico, el cuál contiene las vesículas sinápticas incluyendo en su interior a los neurotransmisores, que son sustancias químicas responsables de transmitir los mensajes a la neurona que le sucede.
Las dendritas, con número y estructura variable según el tipo de neurona, y que transmiten los potenciales de acción desde las neuronas adyacentes hacia el cuerpo celular o soma.
Se unen entre ellas por contacto físico en una sinapsis eléctrica, y con una hendidura en una sinapsis química. Esta unión discontinua se llama sinapsis.
Son células excitables especializadas para la recepción de estímulos y la conducción del impulso nervioso.
Las dendritas, con número y estructura variable según el tipo de neurona, y que transmiten los potenciales de acción desde las neuronas adyacentes hacia el cuerpo celular o soma.
Se unen entre ellas por contacto físico en una sinapsis eléctrica, y con una hendidura en una sinapsis química. Esta unión discontinua se llama sinapsis.
Son células excitables especializadas para la recepción de estímulos y la conducción del impulso nervioso.
Las neuronas se hallan en el encéfalo, la médula espinal y los ganglios nerviosos y están en contacto con todo el cuerpo. A diferencia de la mayoría de las otras células del organismo, las neuronas normales en el individuo maduro no se dividen ni se reproducen (como una excepción las células olfatorias sí se regeneran). (Los nervios mielinados del sistema nervioso periférico también tienen la posibilidad de regenerar a través de la utilización del neurolema, una capa formado de los núcleos de las células de schwann).
. Esto se conoce en la neurociencia moderna como doctrina neurona. Para observar la estructura de una neurona, Cajal utilizó el método de Golgi, desarrollado por su rival Camilo Golgi.
Variedades de neuronas
Aunque el tamaño del cuerpo celular puede ser desde 5 hasta 135 micrómetros, las prolongaciones o dendritas pueden extenderse a una distancia de más de un metro. El número, la longitud y la forma de ramificación de las dendritas brindan un método morfológico para la clasificación de las neuronas.
Clasificación según el tamaño
Según el tamaño de las prolongaciones, las neuronas se clasifican en:
Las neuronas Golgi tipo I que tienen axón largo (pueden llegar a medir un metro), y, generalmente, mielínico.
Las neuronas Golgi tipo II que tienen axón corto.
Las células piramidales de la corteza cerebral.
Las voluminosas células de Purkinje de la corteza cerebelosa.
Las grandes neuronas motoras de la médula espinal.
Clasificación según la polaridad
Neuronas unipolares
Las neuronas unipolares son aquellas en las cuales el cuerpo celular tiene una sola dendrita que se divide a corta distancia del cuerpo celular en dos ramas, motivo por cual también se les denomina pseudounipolares (pseudos en griego es falso), una que se dirige hacia una estructura periférica y otra que ingresa en el sistema nervioso central. Se hallan ejemplos de esta forma de neurona en el ganglio de la raíz posterior.
Neuronas bipolares
Las neuronas bipolares poseen un cuerpo celular alargado y cada uno de sus extremos parte de una dendrita única. El núcleo de este tipo de neurona se encuentra ubicado en el centro de ésta, por lo que puede enviar señales hacia ambos polos de la misma. Ejemplos de estas neuronas se hallan en las células bipolares de la retina(conos y bastones), del ganglio coclear y vestibular, estos ganglios son especializados de la recepción de las ondas auditivas y del equilibrio.
Neuronas multipolares
Las neuronas multipolares tienen una gran cantidad de dendritas que nacen del cuerpo celular. Ese tipo de células son la clásica neurona con prolongaciones pequeñas (dendritas) y una prolongación larga o axón. Representan la mayoría de las neuronas.
Neuronas pseudounipolares
Tienen una sola prolongación, la cual se divide en una sola rama que entra al sistema nervioso central y otra rama periférica. Este tipo de neuronas se encuentra en los glanglios de las raíces dorsales de los nervios espinales.
Neuronas apolares
No producen señales, pero las reciben.
Clasificación según su función
Neuronas Sensitiva o Aferente
Son aquellas que conducen el impulso nervioso desde los receptores hasta los centros nerviosos. (captan la informacion del entorno)
Neuronas Asociativas o Interneuronas
Aquellas que comunican neuronas entre sí. Este tipo de neurona se encuentra exclusivamente en el sistema nervioso central.
Neuronas Motoras o eferentes
Aquellas que llevan el impulso nervioso desde los centros nerviosos hasta los órganos efectores.
Estructura
El cuerpo de la célula nerviosa consiste esencialmente en una masa de citoplasma en la cual está incluido el núcleo. El volumen del citoplasma dentro de la célula nerviosa a menudo es mucho menor que el volumen del citoplasma total de las dendritas.
El núcleo comúnmente se ubica en el centro del cuerpo celular y típicamente es grande y redondeado. En las neuronas maduras, los cromosomas ya no se duplican y sólo funcionan en la expresión genética. Por lo tanto el núcleo es pálido y los finos gránulos de cromatina están muy dispersos. Generalmente hay un nucléolo único prominente que está relacionado con la síntesis de ácido ribonucléico ribosomal (rRNA). El gran tamaño del núcleo probablemente se debe a la alta síntesis proteica.
En la mujer, uno de los cromosomas X es compacto y se conoce como Corpúsculo Barr. Se localiza sobre la superficie interna de la envoltura nuclear.
La envoltura nuclear se puede considerar una porción del retículo endoplásmico rugoso. la envoltura tiene doble capa es decir forma una cisterna, las cisternas están unidas por el denominado complejo de poro, que está formado por ocho proteínas que irradian hacia el centro de una proteína central (como los radios de una bicicleta), sirve para que sustancias de gran peso molecular, como por ejemplo proteínas, pasen al núcleo y desde el núcleo al citoplasma.
El citoplasma es rico en retículo endoplásmico (granular y agranular) y contiene las siguientes organelas principalmente: gránulos de Nissl (formado por el retículo endoplásmico rugoso), aparato de Golgi, mitocondrias, microfilamentos, microtúbulos, lisosomas, centriolos, lipofuscina, melanina, glucógeno y lípidos.
Los microfilamentos y los microtúbulos se originan en el soma y continúan por las dendritas formando el citoesqueleto neuronal, manteniendo la arquitectura del citoplasma. Los gránulos de Nissl dan al soma un aspecto atigrado.
. Esto se conoce en la neurociencia moderna como doctrina neurona. Para observar la estructura de una neurona, Cajal utilizó el método de Golgi, desarrollado por su rival Camilo Golgi.
Variedades de neuronas
Aunque el tamaño del cuerpo celular puede ser desde 5 hasta 135 micrómetros, las prolongaciones o dendritas pueden extenderse a una distancia de más de un metro. El número, la longitud y la forma de ramificación de las dendritas brindan un método morfológico para la clasificación de las neuronas.
Clasificación según el tamaño
Según el tamaño de las prolongaciones, las neuronas se clasifican en:
Las neuronas Golgi tipo I que tienen axón largo (pueden llegar a medir un metro), y, generalmente, mielínico.
Las neuronas Golgi tipo II que tienen axón corto.
Las células piramidales de la corteza cerebral.
Las voluminosas células de Purkinje de la corteza cerebelosa.
Las grandes neuronas motoras de la médula espinal.
Clasificación según la polaridad
Neuronas unipolares
Las neuronas unipolares son aquellas en las cuales el cuerpo celular tiene una sola dendrita que se divide a corta distancia del cuerpo celular en dos ramas, motivo por cual también se les denomina pseudounipolares (pseudos en griego es falso), una que se dirige hacia una estructura periférica y otra que ingresa en el sistema nervioso central. Se hallan ejemplos de esta forma de neurona en el ganglio de la raíz posterior.
Neuronas bipolares
Las neuronas bipolares poseen un cuerpo celular alargado y cada uno de sus extremos parte de una dendrita única. El núcleo de este tipo de neurona se encuentra ubicado en el centro de ésta, por lo que puede enviar señales hacia ambos polos de la misma. Ejemplos de estas neuronas se hallan en las células bipolares de la retina(conos y bastones), del ganglio coclear y vestibular, estos ganglios son especializados de la recepción de las ondas auditivas y del equilibrio.
Neuronas multipolares
Las neuronas multipolares tienen una gran cantidad de dendritas que nacen del cuerpo celular. Ese tipo de células son la clásica neurona con prolongaciones pequeñas (dendritas) y una prolongación larga o axón. Representan la mayoría de las neuronas.
Neuronas pseudounipolares
Tienen una sola prolongación, la cual se divide en una sola rama que entra al sistema nervioso central y otra rama periférica. Este tipo de neuronas se encuentra en los glanglios de las raíces dorsales de los nervios espinales.
Neuronas apolares
No producen señales, pero las reciben.
Clasificación según su función
Neuronas Sensitiva o Aferente
Son aquellas que conducen el impulso nervioso desde los receptores hasta los centros nerviosos. (captan la informacion del entorno)
Neuronas Asociativas o Interneuronas
Aquellas que comunican neuronas entre sí. Este tipo de neurona se encuentra exclusivamente en el sistema nervioso central.
Neuronas Motoras o eferentes
Aquellas que llevan el impulso nervioso desde los centros nerviosos hasta los órganos efectores.
Estructura
El cuerpo de la célula nerviosa consiste esencialmente en una masa de citoplasma en la cual está incluido el núcleo. El volumen del citoplasma dentro de la célula nerviosa a menudo es mucho menor que el volumen del citoplasma total de las dendritas.
El núcleo comúnmente se ubica en el centro del cuerpo celular y típicamente es grande y redondeado. En las neuronas maduras, los cromosomas ya no se duplican y sólo funcionan en la expresión genética. Por lo tanto el núcleo es pálido y los finos gránulos de cromatina están muy dispersos. Generalmente hay un nucléolo único prominente que está relacionado con la síntesis de ácido ribonucléico ribosomal (rRNA). El gran tamaño del núcleo probablemente se debe a la alta síntesis proteica.
En la mujer, uno de los cromosomas X es compacto y se conoce como Corpúsculo Barr. Se localiza sobre la superficie interna de la envoltura nuclear.
La envoltura nuclear se puede considerar una porción del retículo endoplásmico rugoso. la envoltura tiene doble capa es decir forma una cisterna, las cisternas están unidas por el denominado complejo de poro, que está formado por ocho proteínas que irradian hacia el centro de una proteína central (como los radios de una bicicleta), sirve para que sustancias de gran peso molecular, como por ejemplo proteínas, pasen al núcleo y desde el núcleo al citoplasma.
El citoplasma es rico en retículo endoplásmico (granular y agranular) y contiene las siguientes organelas principalmente: gránulos de Nissl (formado por el retículo endoplásmico rugoso), aparato de Golgi, mitocondrias, microfilamentos, microtúbulos, lisosomas, centriolos, lipofuscina, melanina, glucógeno y lípidos.
Los microfilamentos y los microtúbulos se originan en el soma y continúan por las dendritas formando el citoesqueleto neuronal, manteniendo la arquitectura del citoplasma. Los gránulos de Nissl dan al soma un aspecto atigrado.